|
|
Periodiska systemetEn skäggig ryss vid namn Dimitrij Mendelejev som gillade kortspel, satt på 1860-talet i Sankt Petersburg och grunnade på om det inte gick att ordna alla dessa grundämnen på något smart sätt. På hans tid hade grundämnena redan hunnit bli 63 stycken. Var det kanske möjligt att få till det lite som ruter, klöver, spader och hjärter i en kortlek och deras valörer från ess till kung?
Dimitrij lyckades med sin patiens och idag kan vi ordna in 118 grundämnen i det periodiska system som han och andra la grunden till på 1800-talet. Det periodiska systemet är förstås inget som går att upptäcka. Det är bara ett sätt vi människor valt att ordna grundämnena så att vi lättare ska förstå och komma ihåg deras egenskaper. Till exempel att arsenik (As) bildar liknande molekyler som fosfor (P) när det förenar sig med andra ämnen. Likaså att guld (Au) och silver (Ag) har egenskaper som är lika. Det går också att utläsa att de livsnödvändiga ämnena kalcium (Ca) och magnesium (Mg) kan bilda joner med två positiva laddningar. Periodiska systemet - en bruksanvisningDet går att ”läsa” det periodiska systemet på olika sätt, och här ska vi bara ta upp de allra enklaste. Från vänster till höger ökar atomernas vikt och uppifrån och ned i varje kolumn har vi grundämnen som liknar varandra. Vissa egenskaper återkommer periodvis, det vill säga med jämna mellanrum. Det är då vi börjar på en ny rad. Varje rad kallas för en period. De grundämnen som är markerade med grått ligger också inne i periodiska systemet. För att spara plats läggs de oftast underst.
Ordnar vi korten i en kortlek från ett (ess) till tretton (kung) för klöver och sedan börjar om med ruter i raden under, hjärter sedan och sist spader, så får vi tretton kolumner och fyra rader. Alla fyrorna ligger nu i samma kolumn. Kemisterna kallar kolumnerna i det periodiska systemet för ”grupper”. Alla kort i samma kolumn har samma egenskap, de är värda 4, men har olika ”färg”. Halogener tar gärna upp en extra elektron
På ett liknande sätt har det periodiska systemet 18 kolumner. Ett exempel är kolumn 17 där vi hittar en grupp grundämnen som gärna tar upp en extra elektron och bildar laddade joner med laddningen minus ett. Här hittar vi till exempel fluor (F) med fluoridjonerna (F-) som finns i tandkräm, och klor (Cl) med kloridjonerna (Cl-) som vi hittar i vanligt salt. Här hittar vi även jod (I). Jods negativa jodidjoner (I-) är viktiga för att vår kropp ska kunna tillverka vissa hormoner i sköldkörteln. Brist på jodidjoner ger upphov till en rad allvarliga problem för både vuxna och barn. Cirka 800 miljoner människor lider av jodbrist i högre eller mindre grad. Därför kan vi i Sverige och i många andra länder köpa koksalt med tillsatts av jodidjoner. För att jodera koksalt (NaCl) tillsätts kaliumjodid (KI). Både natriumjoner och kaliumjoner har en plusladdning. De står också i samma kolumn i periodiska systemet eftersom de bildar joner med samma laddning. Kaliumjoner (K+) är också nödvändiga för vår kropp.
Ädelgaser bildar helst inte kemiska föreningarNär vi lagt upp korten i en vanlig kortlek har vi kungarna längst till höger. I det periodiska systemet motsvaras kungarna av ädelgaserna. Det börjar med helium (He) högst upp. Det är ett grundämne vi inte har någon nytta av i våra kroppar. Det kan ändå vara ett livsviktigt ämne. Helium används nämligen i magnetkameror på sjukhus. Med en magnetkamera kan vi upptäcka till exempel cancertumörer.
Sist i kolumnen hittar vi det syntetiskt framställda oganesson (Og). Det är just nu det sista grundämnet och har nummer 118 i det periodiska systemet. Däremellan kommer neon (Ne) som finns i neonskyltar, argon (Ar) som används som isolering i flerglasfönster, krypton (Kr) och xenon (Xe) som också används för att skapa ljus på olika sätt. Sist av de naturligt förekommande ädelgaserna hittar vi radon, som är radioaktiv. Ädelgaserna reagerar ogärna med andra ämnen och inte ens med sig själva. I en heliumballong finns alltså bara enskilda heliumatomer, inga molekyler. Det är därför de kallas ”ädla”. Ett mer kemiskt uttryck är inerta. Inert betyder att de inte gärna reagerar med andra ämnen. Det är dock inte helt sant. Ju längre nedåt vi rör oss i ädelgasgruppen desto mer reaktiva blir ädelgaserna. De är fortfarande ganska oreaktiva i jämförelse med andra grundämnen. Hur ädelgasernas egenskaper förändras när vi rör oss nedåt i gruppen ger oss också en ledning till hur det står till i andra grupper. Liknande gradvisa ändringar av egenskaper kan vi se i alla grupper. Det går därför inte att anta att grundämnena beter sig exakt lika bara för att vi hittar dem i samma grupp.
Ett fåtal grundämnen finns i ren form i naturenEtt fåtal grundämnen kan vi hitta i ren form i naturen. Förutom ädelgaserna är det till exempel de vanliga gaserna syrgas (O2) och kvävgas (N2) i luften. Vi hittar svavel (S8) i områden med vulkaner, och så grupp 11, myntmetallerna koppar (Cu), silver (Ag) och guld (Au). Dessutom kan vi hitta rent kol (C) i form av diamant.
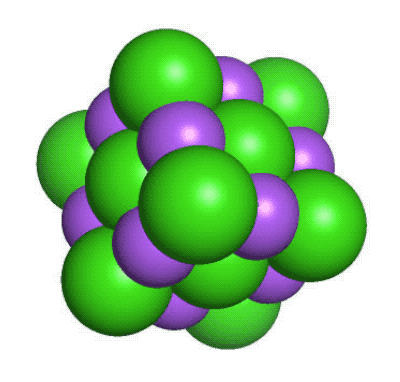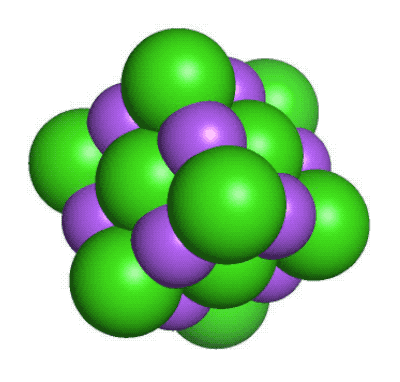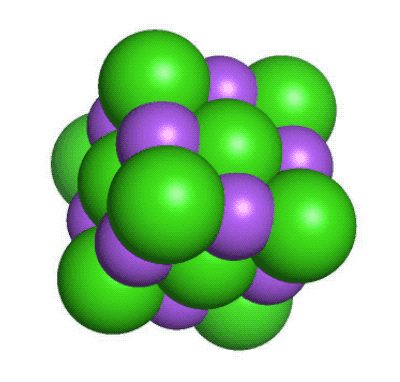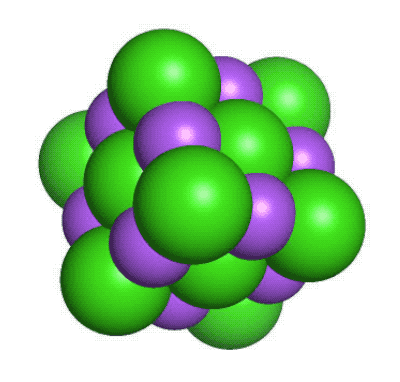
De flesta andra atomslag finns bara i form av kemiska föreningar, där två eller flera atomer sitter ihop med olika typer av kemiska bindningar. De bildar då ämnen som har helt andra egenskaper än de atomslag de är uppbyggda av. Ett exempel är vanligt koksalt, en kemisk förening mellan den mycket reaktiva metallen natrium (Na) och den giftiga gasen klor (Cl2). Det blir NaCl, ett ämne som varken är giftigt eller reaktivt och som vi behöver tillföra till våra kroppar för att överleva.
En liten del av en kristall med natriumklorid. Natriumjonerna är lila medan kloridjonerna är gröna. Det går att tillverka nya grundämnenFör att förstå hur protonerna i atomkärnan stöter bort varandra och hur neutroner hjälper till att hålla samman kärnan så skapar forskarna nya atomer och isotoper. Speciellt spännande blir det när man gör atomkärnor som har fler protoner än andra kända grundämnen. Då är det nämligen frågan om ett nytt grundämne som efter grundliga utvärderingar kanske kan få ta plats i det periodiska systemet. Ett exempel på ett sådant nytt syntetiskt grundämne är californium (Cf med atomnummer 98). Det framställdes första gången 1950 av svenskättlingen och kemisten Glenn Seaborg och hans medarbetare i Berkeley, Kalifornien. Sedan dess har vi fått många nya grundämnen, bland dessa seaborgium (Sg med atomnummer 106). De nya grundämnena tillverkas genom att låta två lättare atomer kollidera med varandra med stor kraft. Med lite tur så slås de då ihop till en ny slags atom. Det är inte ofta detta sker, så forskarna får ha både tur och rejält med tålamod. Ibland kan det ta veckor eller månader att bilda en enda atom. Men varje gång det lyckas får vi en ny pusselbit i vår förståelse för hur atomkärnan sitter ihop.
Quiz - Periodiska systemetUppgifter - Periodiska systemet
Förklara och beskriv
Argumentera och resonera
Ta reda på
|